8. パージを伴う循環プロセス
8.1 不活性ガスとパージ
反応物(原料)は少なからず反応に関与しない物質、すなわち不活性ガスを含んでいます。アンモニア合成においても窒素源を空気に求める限り、アルゴン(Ar)などの不活性ガスがプロセス内に取り込まれます。その結果、どのような現象が発生するでしょうか。そして対策は・・・。
8.2 パージと不活性ガス
アンモニア合成プロセス(以下、システムと呼称します)に供給される水素は天然ガスから得ています(水蒸気改質法)。また、窒素は空気を源としていますので、空気中に存在するArなどの不活性ガスがシステムに取り込まれてしまいます。水素や窒素はアンモニアを生成するために消費されますので、循環システム内では濃度が低下します。これに対しArは消費されませんのでArはシステム内に蓄積していきます。もし、Arをシステムから排出しないとAr濃度は次第に上昇し、相対的に水素+窒素濃度は低下していきます。そうなると水素+窒素の分圧が低下してアンモニア合成反応が大きく阻害されてしまいます。そのために考えられた操作が「パージ」という操作です。
「パージ」はシステム内のガスの一部を外部に排出する操作で、その際、Arを水素+窒素から分離できなければ、Arと一緒に水素と窒素がパージによって失われてしまいます。つまり、パージを伴う循環システムでは水素と窒素のアンモニアへの転化率、つまり、原単位が低下します。この一部のガスをパージする箇所はどこでも良いというわけではなく、パージによる水素と窒素およびアンモニアの損失が最も少ない箇所、つまり、アンモニアが分離され、かつAr濃度が最も高くなる場所が選ばれます。下図のシステムではアンモニア分離器を出た循環ガスが流れるラインが選ばれます。
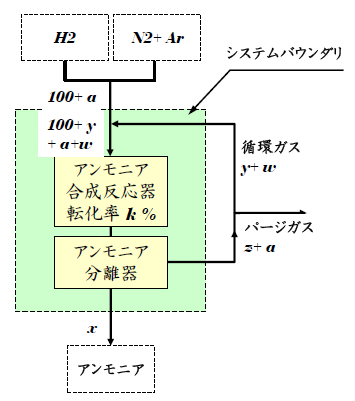
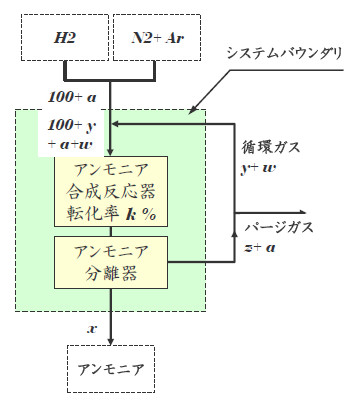
8.3 パージ量と製品生産量
ここからは物質収支計算を使い定量的な話をしていきます。
システムに供給される水素と窒素の合計量を100kmol/hとします。ただし、その比はアンモニア合成の量論比(3:1)にします。Ar量(a)は一般的な空気の組成(N2:O2:Ar = 78:21:1)から0.32kmol/hと設定します。また、パージガス中の水素と窒素の合計量をz kmol/h、勿論、そこに含まれるべきAr量(a)は 0.32kmol/hとなります。パージ後の循環ガス中の水素と窒素の合計量をy kmol/h、そしてAr量をw kmol/hとします。また、製品アンモニアの生産量は前回では50kmol/hでしたが、このシステムでは水素と窒素の一部がパージガスに含まれてシステム外に排出されますので、製品アンモニアの生産量が減少します。そこで、このアンモニア生産量を変数 x kmol/hとします。
製品アンモニアに水素や窒素だけではなくArも溶解して外部に出て行きますが、ここではアンモニアへの溶解量は考慮していません。
物質収支計算を行うためには以下に示す二つのパラメーターを設定しなければなりません。
- アンモニア合成反応器での転化率: 上図ではk %で、ここでは20%に設定します。
- アンモニア合成反応器入口のArレベル: 上図ではa+w/(100+y)で、ここでは0.04に設定します。
アンモニア合成の不活性ガスとしてはAr以外に良く知られているのがメタン(CH4)です。アンモニア合成で良く耳にするイナートレベル(inert level)は、アンモニア合成反応器入口における不活性ガス(ArやCH4)の濃度を指し、a+w/(100+y+a+w)で計算します。
問題を簡単に解説するために、アンモニア合成反応器入口での水素と窒素の合計量を100molにします。以下に、回答を得るまでの手順を示していきます。(以下の内容は”Handbook of Chemical Engineering Calculations”の"§2-6 Material Balance-Chemical Reaction, Recycle Stream, and Purge Stream Involved"を参考にしました。
- アンモニア合成反応器での転化率が20%ですので、システムに供給される水素と窒素の合計(100mol)の20%がアンモニアに転換され、残り80%(80mol)がアンモニア分離器を出た循環ガス(パージガスも含む)となります。
- Arの許容レベルが0.04ですので、アンモニア合成反応器入口ではAr 4mol、水素と窒素の合計100molとなり、反応器出口ガス、循環ガスおよびパージガスではAr 4mol、水素と窒素の合計80molとなります。
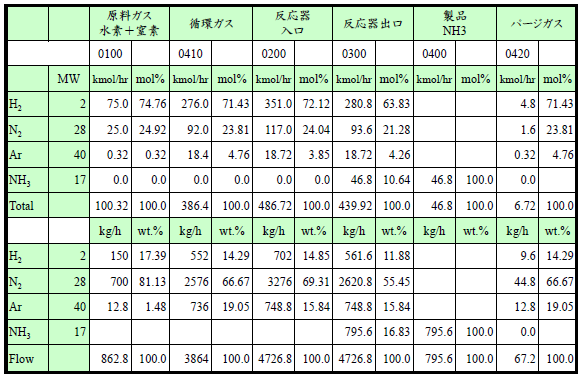
- パージガスに含まれるArは0.32kmol/hですので、4:80 = 0.32:z の関係が成立し、(4/80)z=0.32kmol/h から z = 6.4kmol/hとなります。つまり、パージガス量はH2+N2=6.4kmol/h & Ar 0.32kmol/h、合計で6.72kmol/hとなります。
- 反応器に供給される水素と窒素の合計量は100+yで、その80%が循環ガスとパージガスに含まれる水素と窒素の合計量(y+z)に等しくなりますので、循環ガス中の水素と窒素の合計量(y)の計算式は、(100+y)0.8=y+z=y+6.4, y=368kmol/h。
- 反応器入口のAr量は0.32+wで、(0.32+w)/(100+y) =0.04ですので、w=18.4kmol/h。
- 最後にアンモニア生産量は転化率が20%で、(H2+N2) 4molから 2molのNH3が生成しますので、(100+y)0.2×(2/4)=(100+368)0.2×0.5=46.8kmol/hとなります。
このようにパージを行うことでアンモニア生産量は50kmol/hから46.8kmol/h、つまり、6.4%の減少となります。下表に物質収支の計算結果を示しますので、システム全体の入出の質量が等しいことを確認してみて下さい。
製品アンモニア 795.6kg/h+パージガス 67.2kg/h = 862.8kg/h → 原料ガス862.8kg/h
次回の「循環プロセスのパラメータ」では”転化率が変わった場合のパージ量と循環ガス量の変化”などについて考えて見ましょう。
- 第1章 商品開発を始める前に
- 1.1 商品開発の意義
- 1.2 商品開発のリードタイム
- 1.3 商品開発プロジェクトの発足
- 1.4 Kickoff Meetingの開催
- 第2章 商品開発の目的と目標
- 2.1 差別化の尺度
- 2.2 製品品質
- 2.3 製品生産量
- 2.4 製品コストと原単位
- 2.5 廃棄物と環境負荷
- 2.6 商品開発の目標
- 第3章 商品開発とプロセスの最適化
- 3.1 Proprietary Equipmentの定義
- 3.2 商品開発とProprietary Equipment
- 3.3 プロセスの最適化のステップ
- 第4章 プロセス最適化の具体例
- 4.1 最適化の手順
- 4.2 原料原単位の改善
- 第5章 エネルギー原単位
- 5.1 エネルギー原単位と燃料原単位
- 5.2 エネルギー原単位の種類
- 5.3 バウンダリと物質収支
- 5.4 バウンダリに供給されるユーティリティ
- 第6章 スチーム原単位
- 6.1 スチームシステムとスチームの温度と圧力
- 6.2 スチームの用途
- 6.3 スチーム原単位とエネルギー原単位
- 第7章 循環を伴う化学プロセス
- 7.1 循環プロセスとは
- 7.2 アンモニア合成反応
- 7.3 循環システムと転化率
- 第8章 パージを伴う循環プロセス
- 8.1 不活性ガスとパージ
- 8.2 パージと不活性ガス
- 8.3 パージ量と製品生産量
- 第9章 循環プロセスのパラメータ
- 9.1 製品生産量と転化率、循環ガス量と羽0寺領との関係
- 9.2 循環ガス量とパージ量そして製品生産量
- 9.3 転化率と反応器
- 9.4 循環比を変えた場合の製品生産量の推移
- 9.5 転化率を変えた場合の製品生産量の推移
- 第10章 循環プロセスの最適化
- 10.1 循環プロセスの最適化
- 10.2 最適化と経済性評価
- 10.3 既存循環プロセスにおける最適化
- 10.4 アンモニア合成循環プロセスの最適化
- 第 11章 アンモニア製造プロセスの原料原単位
- 11.1 原料原単位
- 11.2 水の熱分解(水の解離)による水素製造
- 11.3 水の電気分解による水素製造
- 11.4 アンモニア製造の原料原単位
- 第12章 アンモニア製造プロセスの燃料原単位
- 12.1 水蒸気改質炉
- 12.2 燃料の種類
- 12.3 ボイラと水蒸気改質炉の熱効率

 前のページへ
前のページへ