3. グリーン水素
グリーン水素は、再生可能エネルギー(太陽光、水力、風力など)を利用して水を電気分解することで得られる水素である。このグリーン水素プロセスは、天然ガスなどの化石燃料を使用しないために二酸化炭素を大気中に排出せずに水素を製造できる。
水電解装置にはアルカリ水電解、固体高分子水電解、固体酸化物電解の3方式がある。
3.1 水電解の概要
水を分離して水素を得るためには、次式に示すように“反応のエンタルピー変化”に相当するエネルギーを供給しなければならない。そのため水電解装置により水素ガスを製造する際には大量の電力を必要とする。
![]()
反応のエンタルピー変化 ΔrHo 285.8 kJ/molは、電圧に換算すると1.481Vになり、これを熱的平衡電圧と呼びます。この反応のエンタルピー変化 ΔrHo 285.8 kJ/molの中で、電気エネルギーでなければならない部分を反応のギブズエネルギー変化 ΔrGo と言い、237.2 kJ/molになります。これが理論分解電圧 1.229Vに相当します。 ここで、ΔrHo > ΔrGoになります。
反応のエンタルビー変化 ΔrHo 285.8 kJ/molと、反応のギブズエネルギ一変化 ΔrGo 237.2 kJ/molとの差 48.6 kJ/molは、電気エネルギーだけでなく、外部から熱を供給することでも可能です。
反応のギブズエネルギー変化 ΔrGoを水1kg当たりの電気エネルギーに換算すると、3.66kWh/kg-H2Oになります。これを水素等量に変更すると、以下のようになります:32.7kWh/kg-H2 または 2.94kWh/Nm3-H2
反応のエンタルピー変化ΔrHoを水1kg当たりの電気エネルギーに換算すると、4.41kWh/kg-H2Oになります。これを水素等量に変更すると、以下のようになります:39.4kWh/kg-H2 または 3.54kWh/Nm3-H2
実際の水電解に必要な電力は、運転条件(温度や圧力)あるいは水電解の方式によっても異なる。また、水電解装置の負荷によっても変わってくる。
3.2 水電解の理論
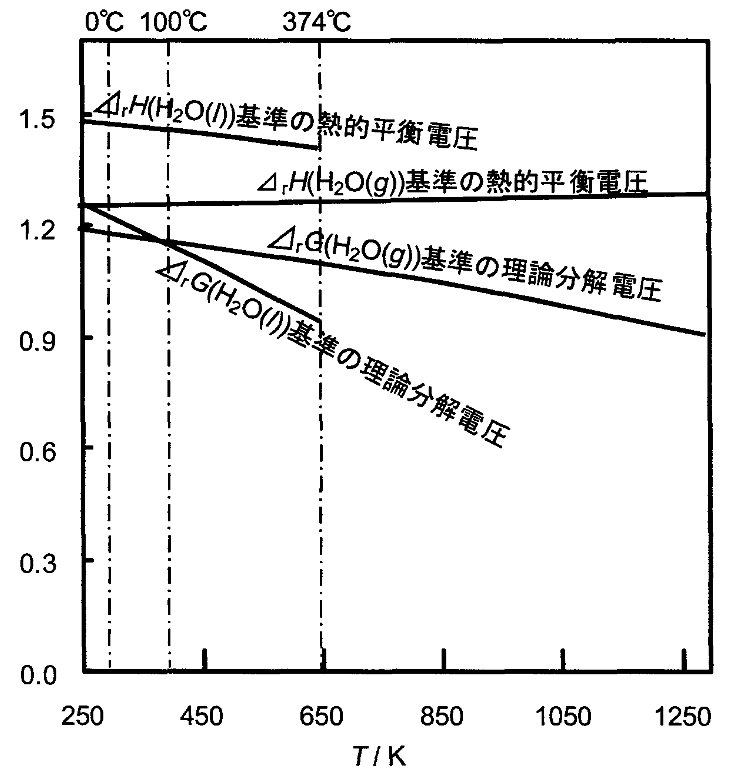
下図に、水(液体、liq)および水蒸気(気体、gas)の電気分解におけるエンタルピー変化とギブズエネルギー変化の温度依存性を示します。横軸には絶対温度、縦軸には相当電圧を示しています。上部横軸には融点、沸点と臨界点(0℃、100℃、374℃)を表しています。
温度が高くなると水電解の理論分解電圧が小さくなり、同時に理論電解電圧と熱的平衡電圧の差が小さくなっています。このことから、固体酸化物電解(SOEC)において、高い効率が実現できている背景が理解できます。
出典:水電解技術の現状と課題:水素エネルギーシステムVo1.36,NO.1 (2011)、光島重徳・松津幸一、横浜国立大
水素の物性 (出典はNIST)
- 分子式 H2、分子量 2.01588
- CAS Registry No. 1333-74-0
- 融点Tf 13.95K、沸点Tb 20.39K
- 臨界温度Tc 33.18K、臨界圧力 Pc 13.00bar
- 燃焼熱 241.8kJ/mol
CO2の回収や貯蔵は、地球温暖化の進行を抑制するために注目されている技術である。CCSは主に以下のプロセスから構成されている。CCS:Carbon Capture and Storage
CO2の捕捉:ここでは、発電所などから排出されるCO2を分離・捕捉する。一般には、アミン溶液などを使う「ガス吸収法」、CO2を膜を用いて分離する「膜分離法」、圧力を変化させて分離する「PSA法」などがあります。
CO2の輸送:捕捉されたCO2は、パイプラインやタンク車などを用いて貯蔵地点まで輸送する。この過程では、CO2を加圧冷却して液体CO2として取り扱う。
CO2の貯蔵:最終的に、CO2は、使われなくなったガス田や油田、塩水層などの地下深くに注入され、長期間にわたって隔離される。これにより、大気中に放出される二酸化炭素の量が減少し、温室効果ガスの削減に寄与します。
CCS技術は、化石燃料の使用が避けられない現在のエネルギー体系において、温室効果ガスの排出削減を目指す重要な手段の一つです。ただし、この技術の経済性、安全性、地質的適合性など、多くの課題があります。また、貯蔵された二酸化炭素が将来的に漏れ出すリスクも検討が必要です。


 前のページへ
前のページへ